研究内容(専門の方)
ハイブリッド型生物モーターのイオン選択透過分子機構の解明
研究の背景
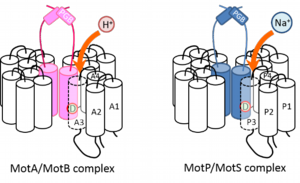
【図】H+駆動型MotA/MotB複合体とNa+駆動型MotP/MotS複合体の概略図
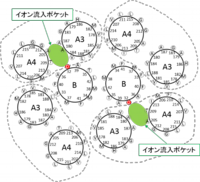
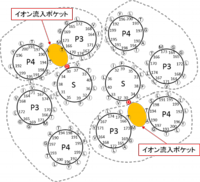
【図】ペプチドグリカン側から見た大腸菌MotA/MotB複合体(左)と枯草菌MotP/MotS複合体(右)の共役イオン流入ポケットの推定図
好アルカリ性細菌Bacillus alcalophilus由来の新奇ハイブリッド型生物モーターの発見
【写真】バチルス・アルカロフィラスは、pH10付近の高アルカリ性環境で活発に増殖する極限環境微生物です。中でもVedder1934株は、1934年にアメリカのVedderによってヒトの排せつ物から分離され報告された最初の好アルカリ性細菌です。
周べん毛性のべん毛モーターをもち、そのモーターは、Na+, Li+, K+, Rb+で駆動する特徴をもつハイブリッド型生体ナノマシンとして機能する。
細菌べん毛モーターのイオン選択透過分子機構の解明
Bacillus属べん毛モーター固定子のイオン選択透過とモーター機能に重要なアミノ酸残基の同定を行っている。これまでにBacillus属細菌が持つMotPS型とMotAB型固定子のモーター機能に重要なアミノ酸残基を特定した。この成果は、2014年に報告した(Takahashi & Ito, J. Biochem., 2014、Takahashi et al, J. Gen. Appl. Microbiol., 2014)。また、イオン選択透過に重要なアミノ酸残基としてB. alcalophilus 由来のNa+/K+/Rb+駆動型固定子のMotSサブユニットの膜貫通領域の33番目のメチオニン残基をロイシン残基に置換(MotS-M33L)するとNa+駆動型は保持しているがK+とRb+での駆動力を失うことを報告した(Terahara et al, PLOS ONE, 2012)。このようにBacillus属細菌の固定子は、MotSの膜貫通領域のアミノ酸残基が共役イオン選択透過に重要な役割を果たしていることが明らかとなってきた。今後、研究を更に進め、イオン選択にかかわるアミノ酸モチーフを明らかにすることで、他のイオン透過タンパク質のイオン選択フィルターとの関連性に収斂進化的な特徴などが見られるのか明らかにしていきたい。
好アルカリ性Bacillus属細菌の高アルカリ性環境適応機構の解明
研究背景
好アルカリ性細菌は多様な分布を示す極限環境微生物の一種であり、その中のいくつかはpH12以上の強アルカリ性環境でも生育することができる。好アルカリ性細菌は、バイオレメディエーションや産業応用に利用される酵素の生産菌としても注目されている。そして、最近では特に“好アルカリ性”とさらに別の極限環境でも生育するような微生物(例えば、好熱好アルカリ性細菌、好冷好アルカリ性細菌、好塩好アルカリ性細菌などのpolyextremophiles)からの有用酵素の分離例も報告されるようになった。近年、好アルカリ性細菌のゲノム解析が増え続けているおかげで、これらのゲノム情報から有用酵素の研究も進められている。さらに、タンパク質工学的手法を用いた耐アルカリ性酵素の改変技術も進歩している。
ところで、多くの好アルカリ性微生物の生育最適pHは10付近にある。これは、通常、よく研究されている好中性微生物とは明らかに異なる。そこで、好アルカリ性細菌の発見以来、なぜ過酷な環境を好んで生きているのか?という疑問があった。これまで報告されている好アルカリ性微生物の細胞内pHは、菌体外pHが8~11のときに8付近にある。従って、好アルカリ性微生物では、細胞表層を隔ててpH差が1.5以上あることになる。この細胞内の中性化には、細胞膜のNa+/H+アンチポーターなどが重要な役割を果たしている。
アルカリ環境適応におけるNa+/H+アンチポーターの役割
Na+/H+アンチポーターは,細胞内へのH+の再取込み経路の一つとして,また,細胞内へ流入するNa+の排出経路としても高アルカリ性環境適応に不可欠な膜内在性タンパク質として知られている。Na+/H+アンチポーターの交換輸送はプロトン駆動力に共役しており,大腸菌NhaAでは1Na+/2H+の交換比率で輸送が行われている。このように、より多くのH+を輸送することで高アルカリ性環境下においても膜電位依存的にNa+を能動輸送することができると考えられている。またNa+/H+アンチポーターはどの生物種においても普遍的に存在するタンパク質であり、細胞内ホメオスタシスにとって重要な役割を担っている。特に好アルカリ性Bacillus属細菌においては、Mrp (マープ;Multiple Resistance and pH adaptation)と呼ばれるNa+/H+アンチポーターが高アルカリ性環境適応において中心的な役割を担っている。
Mrpは,好アルカリ性細菌Bacillus halodurans C-125株のアルカリ感受性変異株を相補する変異箇所として発見された。一般的にNa+/H+アンチポーターの多くは一遺伝子から発現され、単量体もしくはホモ二量体として機能しているものが多い。しかし、Mrpはオペロン構造をとる7つの遺伝子から発現され、そのNa+/H+アンチポート活性には、すべての遺伝子産物を必要とする。発現されるタンパク質はすべて疎水性タンパク質であり、それら遺伝子産物は膜タンパク質複合体を形成している。Mrpは、好アルカリ性細菌に特異的というわけではなく広く真正細菌や古細菌にその相同タンパク質が存在する。それらホモログのmrp遺伝子クラスターの構造は多様性に富んでいる(図)。例えば、Bacillus属細菌由来のmrp遺伝子クラスターなどは7つの遺伝子からなる。一方でコレラ菌などのmrp遺伝子クラスターは、mrpAとmrpBが融合して一つの遺伝子として存在しているため、6つの遺伝子から構成されている。また、シアノバクテリアのMrpは、mrpCとmrpD遺伝子を2つずつ保持する特徴的な遺伝子クラスターから発現される。このように遺伝子構造が多岐にわたるMrpホモログも、基本的にはNa+/H+アンチポーターもしくはK+/H+アンチポーターとして機能し、それぞれの宿主細胞で高アルカリ性環境や高塩性環境への適応に主要な役割を果たしている。近年、イエローストーン国立公園の熱水噴出孔から分離されたThermomicrobium roseum由来のMrpホモログは、Ca2+/H+アンチポーター活性を示した。Mrpにおいても微生物自身の生育環境に適応した共役イオンへと進化が見られることは大変に興味深い。
好アルカリ性Bacillus属細菌における酸化的リン酸化の特徴
好気性好アルカリ性Bacillus属細菌のFoF1-ATP合成酵素やプロトンポンプとして機能する呼吸鎖複合体のcaa3型シトクロム酸化酵素のサブユニットは、アミノ酸配列のマルチアライメント解析により好アルカリ性細菌特有のモチーフを持つことが明らかとなっている。OF4株のFoF1-ATP合成酵素において、この好アルカリ性細菌に特有のモチーフに好中性細菌のものと同じアミノ酸置換変異を導入することで、高アルカリ性環境での生育低下やATP合成能の低下が引き起こされることが報告されている。また中性環境よりも高アルカリ性環境で生育させた好アルカリ性Bacillus属細菌の細胞膜には電子伝達系の成分であるシトクロムが通常の数倍存在する。また,pH10.5で培養したOF4株では,caa3型シトクロム酸化酵素がFoF1-ATP合成酵素よりも4倍量も過剰に発現している。反対にpH7.5で培養したOF4株では,1.6倍しか発現量に差がない。このことから、電子伝達によって排出されるH+は,細胞外液と平衡にならず,細胞膜内で直接FoF1-ATP合成酵素に渡して利用されればATP合成は可能と考えられている。マウントサイナイ医科大学のKrulwich教授らによりこの細胞膜内を介した局所的H+の循環によるエネルギー共役説(図)が提唱されているが、いまだに証明はされていない。現在までに、飽和移動電子スピン共鳴法や示差走査熱量測定法といった手法を用いて試験官内でcaa3型シトクロム酸化酵素とFoF1-ATP合成酵素が共局在していることが報告されている。しかし,実際の細胞内での共局在に関する直接的な証拠は得られていない。ミトコンドリア呼吸鎖では,呼吸鎖複合体やFoF1-ATP合成酵素が超複合体を形成して効率的なプロトン駆動力の利用を図っていることが示唆されている。好アルカリ性細菌においても小さなプロトン駆動力しか得られない高アルカリ性環境でエネルギー共役に関わる膜タンパク質間の距離を近接させることで、呼吸鎖から排出されたプロトンが外環境の水酸化物イオンとの中和に利用されるのではなく、直接的にATP合成酵素にプロトンを受け渡すことによって、より効率的にATP合成を行っている可能性が示唆される。今後、この問題の解明が待たれる.
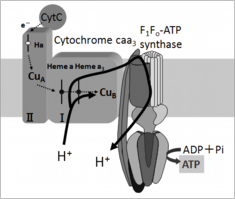
【図】 エネルギー共役説の概略図 シトクロムcaa3とFoF1-ATP合成酵素のタンパク質間相互作用によるプロトンの受け渡しの様子
好アルカリ性Bacillus属細菌の膜電位開閉型Na+チャネル(NaChBac)の生理的機能解明
共同研究先:マウントサイナイ医科大学 Terry Krulwich Lab. ハーバード大学 David Clapham Lab.
研究の背景

NaChBacの特徴は、(1)一次配列は、むしろカルシウムチャネルの配列に似ているが、実際にはナトリウムイオンへの選択性を持っていること。(2) 既知のNa、Caチャネルタンパク質は4つの類似領域を持ち、ここを通ってポリペプチドが膜を6回貫通するが、この新規のチャネルは、このような領域をたった1つしか持っていないこと。(3) 膜電位依存性L型Ca2+チャネル拮抗阻害剤であるニフェジピン(nifedipine)に阻害を受けることなどが挙げられる。
微生物ゲノム解析が進むに従って、細菌から神経や筋肉やその他の組織において多数の重要な生理学的役割を持つほ乳類由来の各種イオンチャネルと相同性をもつタンパク質が発見された。細菌由来のイオンチャネルは、ほ乳類由来のタンパク質では結晶化が難しいイオンチャネルのイオン選択性やゲート開閉の電圧制御について、立体構造解析からの理解に役立っている。そして、2004年には、米国ロックフェラー大学のRoderick MacKinnon教授がStreptomyces lividans のK+チャネルの構造および機構を解明した業績によりノーベル化学賞を授賞している。しかし、これら各種イオンチャネルが実際に原核生物の中でどのような生理学的役割を持っているのかという研究は、Na+チャネルを含めて進んでいなかった。
好アルカリ性Bacillus属細菌におけるNaChBacの生理的役割
なぜ好アルカリ性細菌や海洋から分離された微生物が膜電位開閉型Na+チャネルを持っているのかを調べるために、好アルカリ性細菌Bacillus pseudofirmus OF4株のNa+チャネルNaVBPの構造遺伝子ncbAを欠損させた株を用いて研究を行った)。ncbA欠損株(SC34株)のpH10.5のアルカリ性培地での生育速度は、野生株(OF4-811M株)に比べ差がなかったが、欠損株の菌体収量は、野生株の20%以下であった。アルカリ性培地で生育させたncbA欠損株は、野生株に比べタンブリングの頻度が極端に高くなった。更に、誘因物質と忌避物質に対する走化性試験を行ったところ、SC34株が野生株と逆の走化性を示すことがわかった。この逆の走化性は、欠損株にncbAを戻した株(SC34-R株)で回復した。また、ncbA欠損株のpHホメオスタシス能を調べるために、野生株とncbA欠損株を2.5mMと100mMのNaClを含むpH8.5の菌懸濁液に懸濁後、pHを10.5にシフトし、10分後の細胞内pHを測定した。その結果、ncbA欠損株は、野生株に比べて細胞内pHを保持できないことがわかった。この細胞内pH調節能の低下は、2つのNa+チャネルncbAとmotPSの二重欠損株でさらに顕著に表れた。このことより、NaVBPは、低Na+環境でのpHホメオスタシス維持に関わる主要なNa+流入経路であることがわかった。また、ncbA欠損株が、野生株に比べ運動性に関してタンブリング頻度が上昇し、誘因物質や忌避物質に対する走化性の表現型が野生株と正反対の性質を示すことは、走化性に関わるシグナル伝達経路とNaVBPが相互作用をしていることが期待された。
好アルカリ性細菌Bacillus pseudofirmus OF4株の電位駆動型Na+チャネルの細胞内局在と走化性
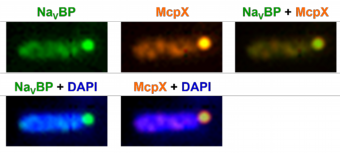
NaChBacファミリーから新規な非陽イオン選択性チャネルの発見
今回のタンパク質は、結果としてナトリウムイオン(Na+)、リチウムイオン(Li +)以外にカリウムイオン(K+)、ルビジウムイオン(Rb + )、 カルシウムイオン(Ca2+)、ストロンチウムイオン(Sr2+)、バリウムイオン(Ba2+)といった陽イオンを輸送することができる新規な非選択性陽イオンチャネルであることがわかりました。今回の発見は、これまでの未解明な点が多かった電位依存性ナトリウムチャネルの選択的イオン透過機構の常識を覆す研究報告で、神経情報伝達や電位依存性ナトリウムチャネルに起因する遺伝的疾患を引き起こす原因の解明にもつながるものです。
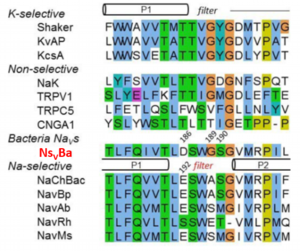
イオン選択性に関わるselective filterは5番目のヘリックスと6番目のヘリックスの間に存在する。好アルカリ性細菌 Bacillus alcalophilus由来のNsVBaはNaChBacファミリーに属する電位依存性チャネルの中でNa+以外も輸送できる非選択性陽イオンチャネルの初めての報告例。


